Atomística e conceitos fundamentais
Dalton 1808: disse que o átomo era uma esfera rígida e indivisível; e que substâncias formadas por elementos em proporções definidas.
Thompson, fim do século XIX: esfera maciça onde, apresenta cargas negativas e positivas.
Milikan: Descobriu a carga e a massa de um elétron.
Rutherford 1911: núcleo positivo denso e em seu redor possui eletrosfera com seus eletrons. Segundo ele os átomos não se encostavam numa na outra. sua falha foi não explicar o fato do núcleo constituintes de partículas positivas na se repelirem
Chadwich 1932: descobriu a existência do nêutron
Rutherford-Bohr: Completou o modelo de Rutherford; falou que todos os elétrons são iguais, mas com energia diferentes demonstrando os orbitais, região do átomo que é mais provável encontrar o elétron; e quando o elétron gira em torno dele ele não perde e nem ganha energia.

Conceitos fundamentais
Número atômico :Também representado pela letra (Z): número de prótons existente no núcleo de um átomo. Em um átomo, onde sua carga é zero o número de prótons é igual ao número de elétrons.
Número de massa: também representado pela letra (A): é a soma do número de prótons e nêutrons existentes num átomo.
Isótopos: São átomos com o mesmo número de prótons.
Isóbaros: São átomos com o mesmo número de massas.
Isótonos: São átomos com o mesmo número de nêutrons.
Nos sabemos que a eletrosfera é dividida em 7 camadas nos quais representamos por letras: K,L,M,N,O,P,Q. onde também são representados por números que chamamos de números quânticos principal(n) respectivamente:1,2,3,4,5,6,7. Cada camada suporta um número máximo de elétrons e orbitais.Esses sub nível (l) também é conhecido como número quântico secundário ou azimutal expresso pelas letras: s, p, d, f como as camadas, eles também são representados por números respectivamente 0,1,2,3 onde o orbital s suporta dois, o p suporta 6, o d suporta 10 e o f, 14 elétrons
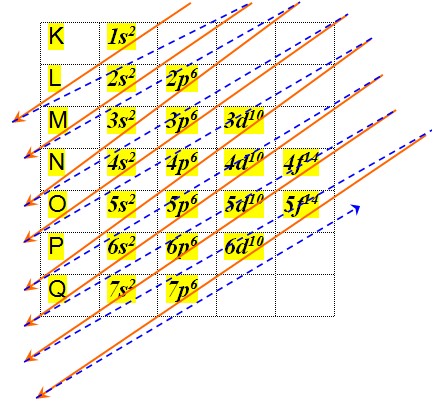
1s2 2s2 2p6 3s2 3p6 4s2 3d104p6 5s2 4d10 5p6 6s2 4f14 5d106p6 7s2 5f146d10 7p6 ...

Ordem crescente de energia


como na imagem cada quadrado é um orbital cada orbital cabe 2 eletrons e para representar o orbital usa-se o número quântico magnético(m), no caso do s o primeiro quadrado é o número 0 no p o primeiro é -1 o segundo é 0 e o terceiro -1 no d é -2,-1,0,1,2 no f é -3,-2,-1,0,1,2,3 (da esquerda para a direita)
ESTRUTURA ATÔMICA
OS PRIMEIROS MODELOS ATÔMICOS
Alguns filosofo da Grécia Antiga já admitiam que toda e qualquer matéria seria formada por minúsculas partículas indivisíveis, que foram denominadas átomos
(a palavra átomo , em grego, significa indivisível).No entanto, foi somente em 1803 que o cientista inglês John Dalton conseguiu provar cientificamente a ideia de átomo.
Surgia então a teoria atômica clássica da matéria. Os principais postulados da Teoria Atômica de Dalton são:
a matéria é formada por partículas extremamente pequenas chamadas átomos;
os átomos são esferas maciças, indestrutíveis e transformáveis;
átomos que apresentam mesmas propriedades (tamanho, massa e forma) constituem um elemento químico;
átomos de elementos diferentes possuem propriedades diferentes;
os átomos podem se unir entre si formando "átomos compostos";
uma reação química nada mais é do que a união e separação de átomos.

MODELO ATÔMICO DE THOMSON
Em 1903, o cientista inglês
Joseph J. Thomson
, baseado em experiências realizadas com gases e que mostraram que a matéria era formada por cargas elétricas positivas e negativas, modificou o modelo atômico de Dalton. Segundo Thomson, o átomo seria uma esfera maciça e positiva com as cargas negativas distribuídas, ao acaso, na esfera. A quantidade de cargas positivas e negativas seriam iguais e dessa forma o átomo seria eletricamente neutro. O modelo proposto por Thomson ficou conhecido como "pudim com passas".


MODELO ATÔMICO DE RUTHERFORD
Em 1911, o cientista neozelandês Ernest Rutherford, utilizando os fenômenos radiativos no estudo da estrutura atômica, descobriu que o átomo não seria uma esfera maciça, mas sim formada por uma região central, chamada núcleo atômico, e uma região externa ao núcleo, chamada eletrosfera. No núcleo atômico estariam as partículas positivas, os prótons, e na eletrosfera as partículas negativas, os elétrons.
Para chegar a essas conclusões Rutherford e seus colaboradores bombardearam lâminas de ouro com partículas a (2prótons e 2 nêutrons) utilizando a aparelhagem esquematizada acima.
Rutherford observou que a grande maioria das partículas atravessava normalmente a lâmina de ouro que apresentava aproximadamente 10-5cm de espessura. Outras partículas sofriam pequenos desvios e outras, em número muito pequeno, batiam na lâmina e voltavam. O caminho seguido pelas partículas a podia ser detectado devido ?s cintilações que elas provocavam no anteparo de sulfeto de zinco.
Comparando o número de partículas a lançadas com o número de partículas a que sofriam desvios, Rutherford calculou que o raio do átomo deveria ser 10.000 a 100.000 vezes maior do que o raio do núcleo, ou seja, o átomo seria formado por espaços vazios. Por esses espaços vazios a grande maioria das partículas a atravessava a lâmina de ouro.
Os desvios sofridos pelas partículas a eram devidos às repulsões elétricas entre onúcleo (positivo) e as partículas a, também positivas, que a ele se dirigiam. O modelo de Rutherford(figura ao lado) ficou conhecido como
"modelo planetário“.




